|
|
 |
 |
|
|
|
|
|
|
|
|
|
|
Click on the flag as the link to the draft English version.
 Wenn Sie zurück auf die
Startseite möchten, bitte
HIER
klicken. Dies ist meine private Web-Site auf privatem Webspace.
Wenn Sie zurück auf die
Startseite möchten, bitte
HIER
klicken. Dies ist meine private Web-Site auf privatem Webspace.
|
Regulatory Science |
& Services |
|
|
|
Univ.- Prof. Dr.
rer. nat. habil.
Harald G. Schweim
Präsident und Professor des BfArM a.D.
ehem. Direktor des DIMDI
Beratungsbüro:
"Regulatory Science & Services"
Mevissenstr. 8, 50668 Köln
Tel.:
0221-7392975
od. -12607377
Fax: -7392963
(siehe
HIER)
.............................................................................................................................. |
 |
................................................................................................ |
.................................................................................................................. |
|
Seit dem 29.02.2016 bin ich
offiziell an der Uni Bonn im Ruhestand und nur noch freiberuflich tätig, u.a. an
der Uni in Leipzig.
Daher bin
ich am leichtesten über meine
Büroadresse in Köln zu erreichen.
In der Uni Bonn bin
ich NICHT mehr.
Ehm.
Adresse:
Lehrstuhl* Drug Regulatory Affairs
Pharmazeutisches
Institut, RFW-Universität Bonn
Uni-Adresse:
c/o
Neuroallianz,
Brühlerstr. 7, 53119
Bonn
|

|
|
|
 |
Finden Sie mich auf: |
|
|
 |

PROFILE |
 |
................................................................................................................................................................................................................................................................................................................................................................................. |
|
ARZNEIMITTELREGULIERUNG
oder wie alles
(in DE) wirklich "Fahrt" aufnahm: |
ResearchGate.net |
What’s
a Regulatory Affairs Manager? (Engish) |
|
 |
 |
 |
|
| Arzneimittelregulierung in Deutschland hat eine wesentliche Wurzel in der
Contergan-Katastrophe der 1960er Jahre. Hier ein historisches Dokument zu
diesem Thema. So musste vor der modernen Arzneimittelregulierung auf
Arzneimittelzwischenfälle reagiert werden. Daher war die primäre
Aufgabe des BfArM und seiner Vorgängerorganisationen auch immer der
Patientenschutz, nicht die Wirtschaftsförderung, wie einige, die nicht aus
der Geschichte lernen können, es heute als (fast) alleinige Aufgabe sehen.
Dass das BfArM, auch unter meiner Leitung, erhebliche Probleme mit den
Zulassungszeiten hatte, sei nicht geleugnet. Die Balance, an der wir zu
meiner Zeit heftig arbeiteten, zugeben (auch auf Grund mangelnder
Unterstützung) mit zu langsamem Fortschritt, macht es. Der Komplexität des
Arzneimittels angemessene Prüfzeiten, verbunden mit der Philosophie, dass
die vornehmste Aufgabe die Versorgung mit geprüften Arzneimitteln mit
positiver Nutzen Risiko-Bewertung ist (und nicht etwa aus Ängstlichkeit die
Versagung der Zulassung: Versagen heißt, keine Nebenwirkungsmeldungen, keine
Nebenwirkungsmeldungen heißt, ich werde befördert) das oberste Ziel des
Arzneimittelgesetzes. "Watchdogfunction" für den Verbraucher UND
Dienstleister. |
Es ist ein trauriges
"Jubiläum", was wir (s.o.) zu gegenwärtigen haben.

Aus meiner kleinen Sammlung pharmaziehistorischer Objekte:
Verkaufspackung "Eisenchloridwatte" ca. 1920, "Aspirin"-Werbeartikel (Rückseite eines Handspiegels) ca. 1960,
"Euphyllin"-Ampullen aus einer Wehrmachtsapotheke ca. 1940
|
Oben: Packung
aus den 60er Jahre mit – heute –
abenteuerlicher Zusammensetzung.
Pflanzlich def.: Extr.
aus Valeriana (es fehlt die Art), Humulus
lupulus, Viscum album, Adonis vernalis.
Chemisch def.
Aminophenazon, Calcium gluconat, Kaliumbromat,
Natrium diethylbarbituricum, Acidum
phenylethylbarbituricum.
Damals
m.W. nicht verschreibungspflichtig.
|
|
|
Hier wird von
früheren Veranstaltungen am Lehrstuhl berichtet. |
|
Dissertationen und
Bildergalerien 2009* -
2013 sind HIER
zu finden! |
|
| * Erst 2004 habe ich
den Dienst an der RFWU-Bonn angetreten. Von der "Kandidatengewinnung"
bis zu deren Abschluss dauert etwas. |
|
Das Wunderbare ist, dass sich die Universität gerne mit den den
Leistungen der Pharmazie
und auch meiner schmückt, besonders
wenn auch noch die Politik diese lobend erwähnt.
|
Was wirklich dahinter steckt, offenbaren die nachstehenden
Fakten: |
|
|
 |
 |
 |


|
|
NEUAUFLAGE:

|
SCIENCE |
|

.......und
wir sind immer noch wissenschaftlich tätig!!
|

|
 |
 |
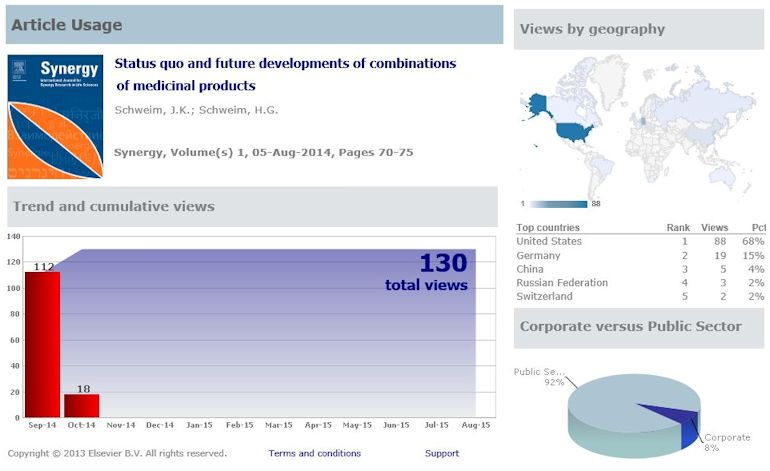
Dear Professor Schweim,
We are pleased to inform you that the final version of
your article with full bibliographic details is now
available online:
Article title: Synergistic effects – is it possible to
make ‘the devil an angel’? Reflections of a senior
regulator
Article reference: SYNRES24 Journal
title: Synergy,
Final version published online: 07-Jan-2017,
DOI information: 10.1016/j.synres.2016.12.002
To help you access and share your
article, we are providing you with the following
personal article link, which will provide free access to
your article, and is valid for 50 days, until February
26, 2017
https://authors.elsevier.com/a/1ULQ77tLmv~AC5
You are also welcome to email the link
to your colleagues, or post the link on your own
homepage, to tell
your network about your new publication. Anyone who
clicks on the link until February 26, 2017,
will be taken to the final version of your article on
ScienceDirect for free. No sign up or registration is
needed - just click and read!

Wir durften an dem o.a. Lehrbuch
mitwirken!

|
|
|
|
|
| |
|
Unsere Informationen über Beratungen usw.: |
|
Für
Kontaktaufnahme empfehle ich primär schweim[at]web.de oder
sekundär 0172-4503-544.
Als Postanschrift bitte mein
Büro in 50668 Köln, Mevissenstr. 8 nutzen !! |
|
Ich suche
weiterhin die Zusammenarbeit mit der
Pharmazeutischen Industrie, Verbänden usw. und freue mich über Anfragen. Als
Dienstleistung werden Zusammenarbeit bei wissenschaftlichen Grundsatzfragen
( z.B. Guidelines, Regulations), Projekten, auf der Basis der
Förderung von Doktorarbeiten oder Einzelgutachten angeboten. Auch die
Beratung und Hilfestellung bei regulatorischen Projekten und Problemen bis
zur regulatorischen Begleitung von Arzneimittelentwicklungen ist mein
Arbeitsgebiet.
Aber auch individuelle "case by case" - Beratung ist möglich.
Ich
rechne in Absprache mit Ihnen nach Stunden- oder günstigeren
Tagessätzen ab, bei erhöhtem Bedarf ist ein pauschalierter Beratervertrag für Sie die Möglichkeit
der Wahl. Mein Impressum und die
aktuellen Honorarsätze finden Sie
HIER auf der
Seite ganz unten. Bitte nehmen Sie Erstkontakt über:
schweim (at) web.de auf.
|
|
Bisher habe(n)
ich bzw. wir für rd. 200 Pharmafirmen (in Deutschland, Europa und weltweit), Apothekerkammern, BKA,
Zollkriminalamt, Landeskriminalämter, Bundesländer,
Nicht-Regierungs-Organisationen, Landes- und Bundesoberbehörden
sowie Zulassungsbehörden Firmen auch in den Ländern der
ECOWAS-Region, China, Jordanien, Nigeria, Russland, Saudi-Arabien, Syrien
und Tansania gearbeitet oder arbeiten aktiv für diese. |
Informationen
zum Lehrstuhl*
|
Am Lehrstuhl bemühten wir uns, Ergebnisse unserer
Forschung, aktuelle Probleme des Faches, der Entwicklung in Medizin und
Pharmazie und der Gesundheits-politik aufzugreifen und der (Fach-)
Öffentlichkeit zu präsentieren. Dazu stehen uns Veröffentlichungen,
Vorträge, Interviews mit Zeitungen, Funk und Fernsehen, ( alles unter "Schriftenverzeichnis")
Vortragsveranstaltungen Symposien u. v. m. zur Verfügung. |
| Ich
(Harald Schweim) lehre derzeit in folgenden
Studiengängen: |
|
Bis
Ende 2015: M.D.R.A.
("Master Drug Regulatory Affairs") an der
RWF-Uni-Bonn (HIER)
|
|
Bis Ende Feb. 2016: M.Sc. in "Drug Research"
an der RWF-Uni-Bonn (HIER) |
|
Letztmalig
2017 M.Sc. in "Consumer
Health Care" an der Charité Universitätsmedizin Berlin (HIER)
|
| M.Sc. in
„Clinical Research & Translational
Medicine“ an der Medizinischen Fakultät der Uni Leipzig, 2018
(HIER) |
|
Letztmalig 2017
M.B.A. (Pharma) an der Goethe Business School
Frankfurt University (HIER). |
| und habe bis 2008 auch im
M.Sc. in "Pharmaceutical Medicine" an der
Université Claude Bernard Lyon 1 gelehrt. |
Seit 2009 läuft der (zulassungsbeschränkte) Studiengang "Arzneimittelforschung"
(Drug Research), der mit dem attraktiven Titel M. Sc. (Master of Science)
abgeschlossen wird. Im Rahmen diese Studienganges konnte man DRA als "Nebenfach", (Wahlpflichtbereich
B), mit 180 h = 6 LP bewertet, besuchen. Der Kurs (WPMB1) begann
immer im
Januar und endete im Dezember. Auf "Semesterferien" nahmen wir keine
Rücksicht, daher war der (dreisemestrige) Kurs in einem Jahr (incl.
Prüfung) zu schaffen. Ein Einstieg war jederzeit möglich. Doktoranden
der Pharmazie in Bonn konnten - so Plätze vorhanden -
(Teilnehmer-bescheinigung, auf Wunsch mit Prüfung und Note) teilnehmen.
Die Möglichkeit wurde von vielen
Pharmazie-Doktorandinnen und Doktoranden genutzt.
|
|
Doktorarbeiten und
Themen am
Lehrstuhl:
Themenbereiche: Arzneimittelfälschungen, Arzneimittel (AM) im
Internet, AM-Erstattungsfragen und AM Regulierungen, Packungsbeilage,
Patienteninformation versus rechtliche Absicherung,
Pharmakovigilanz and Regulation, Phytopharmaka, Zukunft
traditioneller AM, Clinical Trials, regulatorische Kenngrößen (z.B.
Probandenzahl), Follow up to EU-Enlargement, Naher Osten, Adverse Drug
Reactions (ADR) and Impact on Approvals, Impact of Education /knowledge on
Times of Approval, Regulation on Homoeopathics, Medizinprodukterecht
– Arzneimittelrecht – Lebenmittelrecht Vergleiche, Generica, off label use,
u.a.m. Voraussetzung ist ein sehr guter bis guter Studienabschluss in einem
zugelassenen Fach der math.- nat. Fakultät (gemäß § 5 der gültigen
Promotionsordnung)
wie Pharmazie, Biologie, Chemie oder Lebensmittelchemie (StEx, Dipl. oder
Master) oder ein Master (z.B. M. Sc.) in einem
einschlägigen Fach.
Mein letzter
(Pflicht-) Arbeitstag an der Universität Bonn war der 29.02.2016. Daher
nehme ich keine Doktoranden (-innen) mehr an und betreue
auch keine neuen Masterarbeiten o.ä. mehr.
|
|
Von Juni 2009
bis Juni 2018 wurden am Lehrstuhl 26 Dissertationen erfolgreich abgeschlossen: |
|
Herr Apotheker Dr. Daniel Lewinski am 17.06.09, Frau Apothekerin
Dipl. Pharm. Dr. Verena Isabella Schraner, M.D.R.A., am 24.07.09,
Frau Fachapothekerin Dr. Vanessa Plate am 23.10.09, Frau
Apothekerin Dr. Ester Timm-Kilian, M.D.R.A., am 15.01.10, Frau
Apothekerin Dr. Andrea Brigitte Gall am 16.04.10, Herr
Diplom-Biologe Dr. Herbert Büttner am 11.05.10, Frau
Apothekerin Dr. Claudia Hertzsch am 27.07.10, Frau Apothekerin
Dr. Dorothee Brakmann am 28.02.11,
Herr Apotheker
Dr. Matthias Wilken, M.D.R.A ,am 08.04.11, Frau Apothekerin
Dr. Andrea Herrmann, M.D.R.A., am 20.05.11, Frau Fachapothekerin
Dr. Petra Nies am 27.06.11, Herr Apotheker Dr. N´djamawe
Bah-Traore, M.D.R.A., am 07.11.12, Frau Apothekerin Dr.
Christiane Quintus am 30.11.12, Frau Dipl.-Ing. Dr. Kris Pelzer,
M.D.R.A. am 03.12.12, Herr Apotheker Dr. Jörg Schnitzler am
21.01.13, Frau Apothekerin Dr. Katrin Hafner am
15.02.13, Herr Apotheker Dr. Thomas Uhrhan, M. Sc., am 25.07.13,
Frau Dr. Anna C. Wolf, M. Phil., am 23.02.15,
Frau Apothekerin Dr. Jessica Krüger am
26.06.15, Frau Apothekerin Dr.
Iris Annette Müller am 14.10.2015,
Frau Apothekerin Dipl. Pharm. Dr. Agata
Aleksandra Łazowska am 30.09.2016, Frau Apothekerin Dr. Kirsten Berit
Krollmann MSc, am 13.02.2017, Frau Dipl. Ing. Dr. Marlene
Schulzensohn, M.D.R.A., am 25.01.2018, Frau Dr. Jaqueline Anissin, MSc, am
24.04.2018, Frau Apothekerin Dr. Marie Luise Bauer, MSc, am
09.05.2018, Herr Dipl.Biol. Dr. Jürgen Harald Karl Hannig am
29.06.2018.
Die
bisher im Arbeitskreis abgeschlossenen
Dissertationen sind (fast) alle auf dem Diss. -
Server der Math.-Nat.-Fakultät der Universität Bonn publiziert.
|
|
Bildergalerien und Dissertationen 2009 -
2013 sind
HIER
zu finden! |
Als Mitarbeiter sind tätig bzw. waren:
|
Herr Dipl. Biol.
Dr. Jürgen Hannig, Doktorandenstipendium“ (ab Feb. 2915) der
DGRA*** (ausgelaufen). |
|
Frau Apothekerin
Dr. Kirsten Krollmann, M.Sc.
„Doktorandenstipendium“
der DGRA**,
seit Anfang 2014 in
der Industrie. |
|
Frau Apothekerin Dipl.
Pharm. Dr. Agata Lazowska,
Mag. Pharm., Rotary-Stipendium (ausgelaufen)
nachfolgend
„Doktorandenstipendium“ der DGRA**
(ausgelaufen),
jetzt in der EMA.
|
|
Herr Apotheker Stephan Jepards, M.Sc. ,
„Doktorandenstipendium“ der DGRA**
(bis Ende Dez. 2012). |
Herr
Apotheker Dr. NŽdjamawe Bah-Traore, M.D.R.A.,
(ehem. Stipendiat der Friedrich-Ebert-Stiftung, Nov. 2012
ausgeschieden, jetzt Gastwissenschaftler im Kooperationsprojekt
mit der Fakultät Pharmazie und Medizin der
Universität Lomé, Togo).
|
|
Frau Apothekerin
Dr. Maria
Luise Bauer,
M.Sc. (WHK-Stelle, ausgelaufen Mai 2012, und DAAD-Stipendium,
ausgelaufen), |
|
Frau Apothekerin Margret Plum (SHK-Uni-Stelle,
Mai 2011 ausgeschieden). |
Frau Fachapothekerin Dr. V. Plate, „Doktorandenstipendium“
der DGRA,
Projekt „Off
Label Use*“, befristet bis April 2009, weiterbeschäftigt aus
Industrie-Projektmitteln,
Dez. 2009 ausgeschieden. |
|
Frau Dipl.
Dokumentarin K. Schirawski, (Projekt „Off Label Use*“, Feb. 2009
ausgeschieden).
|
|
Herr Dr. med.
Christian Behles, Dir. u. Prof.
(Projekt „Off Label Use*“, Nov.
2008 ausgeschieden, jetzt Gastwissenschaftler).
|
|
Frau Apothekerin Carina Kapoor (
SHK-Uni-Stelle, Jul. 2008 ausgeschieden). |
|
Frau
Rechtsanwältin Dipl. Juristin Janna K. Schweim, M.Sc.
(WHK-Uni-Stelle, Dez. 2008 ausgeschieden, jetzt
Gastwissenschaftlerin). |
| |
| *Das Projekt "Off Label Use" des BMG endete in
seiner "aktiven" Phase zum Dez. 2008, als Projekt im Sept. 2009. |
*** Wir sind außerordentlich
dankbar, dass die DGRA Doktorand(in)en durch Stipendien unterstützt hat und danken allen unseren Sponsoren!!
Mit der Dissertation von
Dr. Hannig endet die Reihe der von mir in Bonn betreuten regulatorischen
Dissertationen. Danke an alle Dissertant(innen) und alle Gutachter(innen)
in den 26 Verfahren.
Mit großer Freude kann ich mitteilen, dass
die sechsundzwanzigste DRA-Dissertation in Bonn
„Qualität
der Kundeninformationen
von Herstellern bei korrektiven
Maßnahmen zu In-vitro
Diagnostika – Analyse
der vom BfArM 2005-2014
publizierten Daten“
von Herrn Dipl. Biol. Jürgen
Harald Karl Hannig
am 29.06.2018
mit der Verteidigung
abgeschlossen wurde.
|

Herzlichen
Glückwunsch! |
Mit großer Freude kann ich mitteilen, dass
die fünfundzwanzigste DRA-Dissertation in Bonn
"Empfehlungen
zur sicheren Anwendung von Arzneimitteln im Off-Label-Use"
von
Frau Apothekerin Maria Luise Bauer, MSc,
am 09.05. 2018
mit der Verteidigung
abgeschlossen wurde.
|

Herzlichen
Glückwunsch! |
Mit großer Freude kann ich mitteilen, dass
die vierundzwanzigste DRA-Dissertation in Bonn
"Einflüsse gesetzlicher Änderungen auf Medizinprodukteunternehmen"
von Frau Jaqueline Anissin,
BSc, MSc, am 24.04. 2018 mit der Verteidigung abgeschlossen wurde. |

Herzlichen
Glückwunsch! |
Mit großer Freude kann ich mitteilen, dass
die dreiundzwanzigste DRA-Dissertation in Bonn
"Biologicals and Biosimilars”
Differences and
implementation of the regulatory requirements in the European Union versus
those in the United States with special consideration and
analysis of the implementation and improvement of safety
standards for Biosimilars
von Frau Dipl. Ing. Marlene
Schulzensohn, M.D.R.A., am 25.01.2018
mit der Verteidigung abgeschlossen wurde.
|

Herzlichen
Glückwunsch! |
Dissertationen 2017
Mit großer Freude kann ich mitteilen, dass
die zweiundzwanzigste DRA-Dissertation in Bonn
"Therapeutic
concepts: Proposing a new regulatory pathway for
combination therapies"
von Frau
Apothekerin Kirsten Berit Krollmann, MSc, am
13.02.2017 mit der Verteidigung abgeschlossen wurde.
|

Herzlichen
Glückwunsch! |
Dissertationen 2016
Mit großer Freude kann ich mitteilen, dass
die einundzwanzigste DRA-Dissertation in Bonn
"Development
of European pharmacovigilance legislation with a focus
on the surveillance of medicine safety in Poland"
von
Frau Apothekerin Dipl. Pharm. Agata Aleksandra Łazowska
am 30.09.2016 mit der Verteidigung abgeschlossen wurde.
|

Herzlichen
Glückwunsch! |
Unsere langjährigen Partner in St. Petersburg und ganz Europa:
 |
Bildergalerien und Weiteres von unserer
zweiten
Phytopharm
2015 sind
HIER zu finden!
Bildergalerien und Weiteres von
unserer ersten
Phytopharm
2009 sind
HIER zu finden! |
Ein Doktorandentreffen 2015 und
2016 gab es leider nicht. Wir sind einfach jetzt
zu Wenige.
Dissertationen 2015
Mit großer Freude kann ich mitteilen, dass
die zwanzigste DRA-Dissertation in Bonn
"Fälschungen pflanzlicher Arzneimittel,
Lebensmittel und Kosmetika,
Regulierung von Arzneimitteln und Lebensmitteln, im Hinblick auf die,
Fälschungssicherheit von pflanzlichen Produkten"
von Frau
Apothekerin Iris Annette Müller am 14.10.2015 mit der Verteidigung abgeschlossen wurde.
|

Herzlichen
Glückwunsch! |
Mit großer Freude kann ich mitteilen, dass
die neunzehnte DRA-Dissertation in Bonn
"Anti-Counterfeiting in Global Pharmacovigilance
A
Question of Patient Safety"
von Frau
Apothekerin Jessica Krüger am 26.06.2015 mit der Verteidigung abgeschlossen wurde.
|

Herzlichen
Glückwunsch! |
|
Mit großer Freude kann ich mitteilen, dass
die achtzehnte DRA-Dissertation in Bonn
"An
Analysis and Evaluation of the Development of the QRD Human
Product Information Template used
in
Package Leaflets*"
von
Frau Anna C. Wolf, M. Phil.
am
23.02.2015 mit der Verteidigung abgeschlossen wurde.
* Mitbetreuung durch Herrn
Dr. Jörg Fuchs, PAINT Consult Jena und
Gastwissenschaftler am Lehrstuhl.
|

Herzlichen
Glückwunsch!
|
Bildergalerien und Dissertationen usw.
bis
2013/14 sind jetzt
HIER
zu finden!
Am 30.08.2014 hatte ich
Besuch von dem
State Food and Drug Administration Institute of
Executive Development , Präsident Deyuan
JIANG mit seinen Mitarbeitern Vizepräsident
Xiaomen WEI und Yang ZHAO (Administrator). Die
Aufgaben des Instituts liegen im Wesentlichen in
der Ausbildung für die SFDA und affiliates.
Näheres unter obigem link. Es wurden erste
Gespräche und Verein-barungen über die
Fortsetzung unserer erfolgreichen Bonner
Ausbildungsarbeit für die SFDA geführt bzw.
getroffen. Herzlichen Dank auch an Frau Jing Yuan
für die Organisation und Übersetzungen!

Wei
Jiang
Schweim
Zhao
| Frau Lazowska hat auf der DIA-Tagung
2014 in San Diego ein Polster präsentiert: |
|
 |
 |
 |
Doktorandentag
2014
|
|
|
Meine Meinung zur Ausbildungsreform: |
|
|
Die
Meldungen zum Thema Arzneimittelfälschungen nehmen so
überhand, dass ich eine Sonderseite
HIER
für Altmeldungen anlegen musste. Neue Meldungen finden Sie unter
"Politik".
--------------------------------------------------------------------------------------------------
Die
Dissertation von Frau Dr. Hafner ist als Buch erschienen:
--------------------------------------------------------------------------------------------------
März 2013

Die DGRA Stipendiatin, Agata Lazowska (Mitte, mit
den Doktorandinnen M.-L. Bauer und K. Krollmann, gleichfalls am
Lehrstuhl DRA in Bonn), hatte beim 25. DIA EuroMeeting 2013 vom
04.- 06. März 2013 in Amsterdam die Gelegenheit die bisherigen
Forschungsergebnisse ihrer Doktorarbeit zu präsentieren. In
ihrer Doktorarbeit beschäftigt sie sich am Lehrstuhl Drug
Regulatory Affairs der Universität Bonn mit der
Pharmakovigilanz-Gesetzgebung in Polen.
--------------------------------------------------------------------------------------------------
Training für die Chinesische
Zulassungsbehörde (SFDA) 2013

 |
Auch 2012
bat die SFDA um ein Training im Herbst zum europäischen Zulassungssystem.
Bedingt durch die Neubestimmung der Chinesischen Führung, musste das
Training aber einerseits auf Feb. 2013 verlegt und andererseits verkürzt
werden. So waren unter der Delegationsleitung von
Mrs.
Wei Jianhua, State Food and
Drug Administration (SFDA)
am
25. und 26.02.2013 zweiundzwanzig Personen
in Bonn zu Gast. Das Training
– organisiert durch Prof. Dr. Harald G. Schweim - wurde unter
Mitwirkung von Kolleginnen und Kollegen aus dem Bundesinstitut für
Arzneimittel und Medizinprodukte (BfArM), dem BAH, Gastwissenschaftlern des
Lehrstuhls, und freiberuflichen Consultants durchgeführt. In dem Bonner
Training, mit Schwerpunkt auf die "New Legislation", wurden sämtliche
Aspekte der Arzneimittelbewertung und -zulassung nach den Regeln der
Europäischen Gemeinschaft und auch das Inspektionswesen behandelt. Besonders
die regen und ausführlichen Diskussionen, in denen auch die chinesischen
Kolleginnen und Kollegen durch ihr großes Fachwissen beeindruckten, zeigten
das große Interesse der chinesischen Gäste an dem europäischen System.
Besonders bemerkenswert ist, dass China inzwischen Etliches aus Europa
übernommen hat. Wir sind stolz, ein Wenig dazu beigetragen zu haben. Ob das
Programm fortgesetzt wird, ist noch nicht entschieden (neue Führung).
Insgesamt wurden in den vergangenen Jahren rd. 130 Personen aus der Zentrale
der SFDA und den Provinzen geschult.
Der neue "starke Mann" in
China Staatspräsident Xi Jinping* hat Ende 2013 die Parole ausgegeben " wir
brauchen keine ausländischen Berater mehr". Daher wurde das Programm 2014 nicht
mehr fortgesetzt.
*Xi Jinping ist ein chinesischer Politiker und seit
2012 Generalsekretär der Kommunistischen Partei Chinas, Vorsitzender der
Zentralen Militärkommission und seit 2013 Staatspräsident der Volksrepublik
China. Xi Jinping ist mit ungewöhnlicher Einstimmigkeit 2018 als Chinas
Präsident und Militärchef im Amt bestätigt und der Volkskongress ihm bereits den
Weg frei,
unbegrenzt viele Amtszeiten regieren zu können. Alle 2970 Delegierten der
nicht frei gewählten Volksversammlung stimmten für den 64-Jährigen.
Normalerweise gibt es zumindest eine geringe Zahl von Gegenstimmen und
Enthaltungen. Geboren: 15. Jun 1953 Größe: 1,80 m Amt: Staatspräsident der
Volksrepublik China (Seit 2013) Ehepartner:
Peng Liyuan (H. 1987) ·
Ke Lingling (H. 1979 - 1982) Kinder:
Xi Mingze (Tochter) Vorheriges Amt: Vizepräsident der Volksrepublik China
(2008 - 2013)
______________________________________________________________________________ |
Ein Blick in den Schulungsraum
.................................................................. |
 |
 |
Mitte: Botschafter a.D. Helmut Wegner, der einen sehr gut
aufgenommenen Vortrag zur Geschichte, Politik, Wirtschaft und
Kultur Deutschlands gehalten hat. |
|
 |
 |
 |
| Dr. B. Lehmann, Vergleich Europa - USA |
Dr. A. Thiele, Neue Pharmakovigilanz |
Dr. C. Haas, Computergestützte Regulatorische
Systeme in Europa |
 |
 |
 |
| Dr. F. Münchberg, Deutsches Gesundheitssystem |
RA A. Frohn, Überwachung von Arzneimitteln |
RA Dr. S. Schmidt, Werbung für Arzneimittel |
 |
|
 |
| RAin Dipl.-Jur. J. Schweim, M.Sc., Überwachung im
Internet |
|
Die ausgezeichnete Fachübersetzerin Frau J. Yuan,
stud. M.D.R.A. |
|
|
Die
Dissertation von Frau Dr. Herrmann ist als Buch erschienen:

 |
 |
______________________________________________________
Herr Bah-Traore hat im Sept. 2011in einigen ECOWAS-Staaten als
"lecturer"
gelehrt und ist dafür von der WHO (Westafrika) ausgezeichnet worden. |
 |

|
| Das Zitat für den Artikel oben: C. Muhl
and H.G. Schweim,
"European regulation of herbal medicinal products on the border area to the
food sector", Phytomedicine, 19, 378 -381 (2012). |
Doktorand und -innen auf der DIA-Tagung 26. - 28. März 2012 in
Kopenhagen |
Weitere
Bilder usw. vor
2013 sind jetzt
HIER
zu finden!
 |
Ich war in Innsbruck, Vortrag zum Vorsymposium der DPhG-Tagung
am 19.09.11. An diesem Tag schneit es bis ins Tal. Links, Blick aus
dem Hörsaal, die "Striche" sind Schneeflocken, rechts der
(begrenzte) Blick auf die Berge am gleichen Tag.
|
 |
............................................................................ |
 |
Manchmal ergeben sich auch "Side-Effects"
aus der
regulatorischen Arbeit:
Nach dem europäischen Patent
EP 08151542 im Jahre 2008 haben wir 2010
auch das US Patent US 7,756,248 B2
erhalten. |
 |
Ich freue mich mitteilen zu können, dass das nachstehende
BMBF-Verbundforschungsprojekt, an dem ich beteiligt sein darf, nicht nur
genehmigt, sondern auch erfolgreich abgeschlossen wurde.


Siehe auch: http://www.ruhr-uni-bochum.de/malakow/bmbf-verb-pm/projektbeschreibung.html
_
 |
Ich war in einer großen Deutschen Universität im Dekanat
der Medizinischen Fakultät zu Gast. Dort konnte ich die nebenstehende Aufnahme
machen.
Selten war mir die überragende Bedeutung dieser
Kommission
im Gefüge der Institutionen in der Medizin klarer als in diesem Moment.
|
|
Für ältere regulatorische Kurzmeldungen (2009/2010)
HIER klicken.
Die
Dissertation von Frau Dr. Gall ist als Buch erschienen:

Die
Dissertation von Frau Dr. Hertzsch ist als Buch
erschienen:
--------------------------------------------------------------------------------------------------
Es kommt m. W. nicht oft vor, dass der BGH in seinen
Urteilsbegründungen Wissenschaftler namentlich zitiert. Wie nachstehend
(Auszug) zu lesen, ist es Frau Dr. Gall und mir in diesem Fall so
widerfahren:
|
 Unsere Arbeit (siehe Leitsätze) trägt das Urteil essentiell mit. Wir empfinden das als Anerkennung unserer Arbeit.
|


|
Die
Dissertation von Frau Dr. Timm-Kilian ist als Buch erschienen:

Die Dissertation von Frau
Dr. Plate ist als Buch erschienen:


Frau Dr. V. Plate stellt als ehem.
DGRA-Stipendiatin ihre Arbeit auf dem DGRA-Jahreskongress 2010 vor.
HIER
können Sie das Poster ansehen.
---------------------------------------------------------------------------------------------------------------------------
| Frau Plate hat in der auf die Verteidigung folgenden Woche auch
noch ihren "Fachapotheker für Arzneimittelinformation", bei dem ich
sie auch betreuen durfte, abgeschlossen.
|
In regelmäßigen Abständen werden die
Zulassungsbehörden, fast "schweinecyclusartig" gelobt und verdammt ob
ihrer Zulassungstrategien. Mal gelten sie als zu streng,
mal als zu
industriefreundlich, wie gerade die politischen Mehrheiten sind. In
Deutschland überwog in den "Ulla-Jahren" der Wunsch den Global-Players
bestmöglich zu
dienen und dabei wurde der (staatstragende) Mittelstand
vernachlässigt. Der beste Schutz für den Verbraucher ist allerdings ein
unabhängige Behörde, die ihre
"watchdog"-Funktion unter gleichzeitiger
Beachtung des Anspruchs, die Verbraucher mit notwendigen Arzneimitteln
zu versorgen ernst nimmt.
Wie der "Cyclus" in der FDA derzeit steht,
nachstehend:

------------------------------------------------------------------------------------------------------------------------
Unser Kampf gegen den
(illegalen) Versandhandel:











------------------------------------------------------------------------------------------------------------------------

Auf das Bild klicken!
| Wir hatten ein
wissenschaftliches Experiment mit einem von uns gefälschten Angebot
einer Internet-Apotheke gemacht. Dieses Experiment ist abgeschlossen und
die links stillgelegt. |
Wenn Sie dafür
interessieren, was ich zum DIMDI-Siegel gemacht habe:
|
|
|
Am 21.04.09 war das Prüfsiegel und das zugehörige
Datenbanksystem "scharf" geschaltet worden. Ich habe - wie viele
Fachleute - großen Zweifel an der Wirksamkeit des Systems und hatte ja
vermutet, dass es nicht lange dauert den "Schutz" auszuhebeln. Als
erstes habe ich mir die passwortgeschützte
DIMDI-Versandapotheken-Namensliste angesehen. |
Zwischenzeitlich ist
das Siegel überholt und durch ein EU-Siegel (etwas sicherer
konstruiert) ersetzt. Oder klicken Sie
HIER
oder klicken Sie hier:
http://www.dimdi.de.
Eine voll verschlüsselte Variante mit preiswerter "shareware" (könnte
sich auch der Bund leisten).
|
|
------------------------------------------------------------------------------------------------------------------------
Internationale
Beziehungen:
 |
From the 10.06.07 until the 14.06.07 we had
visitors from the Arabian Countries Jordan and Syria with
us in Bonn: Dr. Mohammed Saleem, Sips, (left)
and Dr. Nader Chaghlil, Alfares, (right). By courtesy of the
DGRA, they were invitited to attend the anual conference. They
were so impressed that Dr. Chaghlil spontaneously decided to
join the DGRA as a member.
|
|
--------------------------------------------------------------------------------------------------------------------------
Hier wird von
früheren Veranstaltungen berichtet.
--------------------------------------------------------------------------------------------------------------------------
Wenn Sie sich für die
Arzneimittelzulassung in Deutschland vor meiner Amtsübernahme als
BfArM-Präsidentinteressieren:
HIER
Den letzten Stand der BfArM - Performance
unter meiner Leitung finden Sie:
HIER
Der gescheiterte Versuch von Ulla
Schmidt und Theo Schröder das BfArM zur "DAMA" umzuwandeln
HIER
* "Lehrstuhl" ist kein Begriff des
Hochschulrechts in NRW (mehr), aber eine alte akademische Bezeichnung für
eine Einzel-Professur der höchsten Besoldungsstufe ohne weitere planmäßige Professor(inn)en
des gleichen Faches. In diesem alten akademischen Sinn, nur als Bezeichnung,
wird sie hier verwendet.
|
|
|
|


